1.1. ATOMI
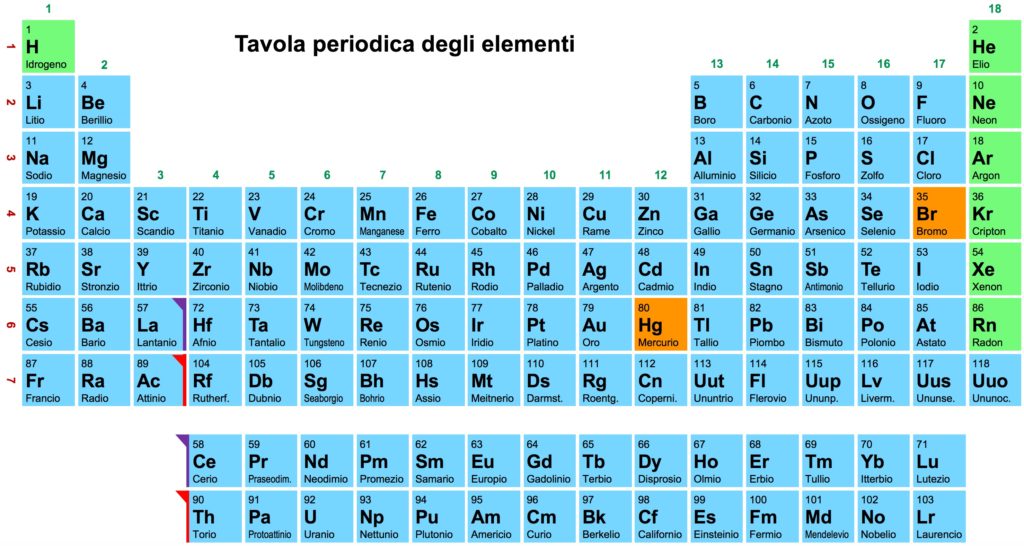
In Natura esistono circa un centinaio di specie atomiche elementari, ciascuna rappresentata con una o due lettere dell’alfabeto: H per l’idrogeno, C per il carbonio, N per l’azoto, O per l’ossigeno, P per il fosforo, S per lo zolfo, Cl per il cloro, Co per il cobalto, ecc. Queste specie elementari, in base alla ripetitività delle loro caratteristiche chimiche e fisiche, sono ordinate nella Tavola Periodica o Sistema Periodico, come l’ha chiamata Primo Levi, chimico e celebre scrittore, in suo famoso libro. La Tavola Periodica (Fig. 1) è nata nel 1869 ad opera di Mendeleev, un chimico russo che per primo mise in evidenza, pur senza capirne i motivi, le similitudini esistenti fra le proprietà degli elementi; secondo molti scienziati, quella di Mendeleev è stata l’idea più brillante degli ultimi dieci secoli. Per parecchi anni la Tavola Periodica è stata guardata come un qualcosa di magico ed è stata circondata da un alone quasi mistico. Anche se oggi i motivi delle similitudini fra i vari elementi sono noti, la Tavola Periodica conserva inalterato tutto il suo fascino, dal momento che nell’ordine palese degli elementi si può intravedere l’ordine intrinseco e profondo della Natura. La Tavola Periodica racchiude in sé, in maniera concisa e unitaria, buona parte della chimica: nessuna altra disciplina scientifica può vantare una simile tavola iconografica.
Gli atomi hanno forma sferica, hanno dimensione diversa per i vari elementi, ma sono tutti molto piccoli: il più grande, l’atomo di cesio (Cs) ha un raggio di 0,24 nm (nm è l’abbreviazione usata per nanometro, il miliardesimo di metro). In generale, gli atomi non stanno isolati; tendono spontaneamente a combinarsi (cioè a dare legami) con altri atomi secondo leggi ben precise per formare le molecole.