2.3. Cambiamenti di forma
Gli enzimi sono strutture globulari costituite da catene di proteine avviluppate. Nell’aggrovigliato ammasso di catene di molecole proteiche che li costituiscono, gli enzimi dispongono di siti specifici (Fig. 15), che sono fessure o cavità di dimensioni e forme molto particolari, capaci di selezionare in modo rigoroso, con un meccanismo di tipo chiave-serratura, l’accesso di molecole esterne. In questi siti avvengono le reazioni chimiche alle quali l’enzima è preposto.
L’accessibilità a questi siti attivi può essere regolata da modifiche strutturali dell’enzima causate da interazioni con molecole esterne. È così che le migliaia di enzimi del nostro corpo possono venire attivati o disattivati dall’organismo stesso, a seconda delle necessità.
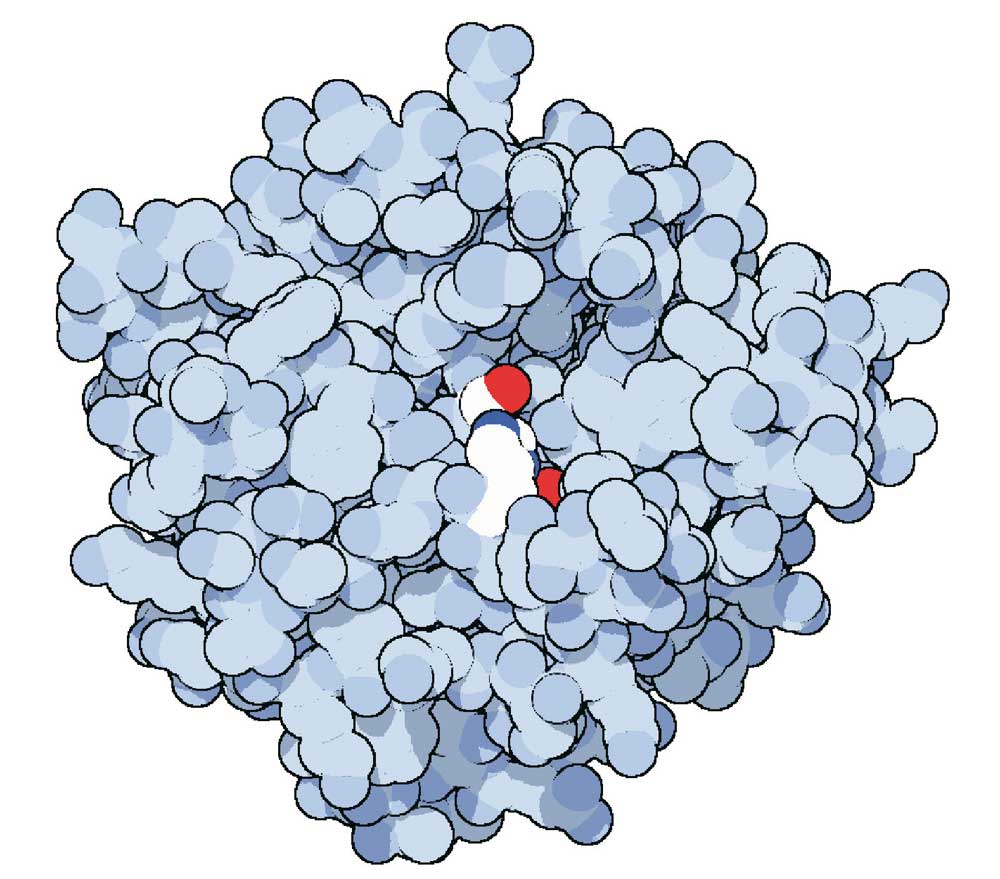
Fig. 15. La chimotripsina è un enzima molto importante per il funzionamento del nostro organismo. In questa rappresentazione tridimensionale si può notare il sito attivo dell’enzima (in colore chiaro) al centro dell’ammasso delle catene proteiche (in grigio). Crediti: RCSC PDB e David S. Goodsell, The Scripps Research Institute, La Jolla, USA.
Tipico esempio di enzima che dispone di un sito attivo attivabile/disattivabile è l’aspartato transcarbammilasi, conosciuto anche come ATCasi. È un enzima presente nelle cellule dei batteri ed è preposto alla sintesi di due molecole molto importanti, la timina e la citosina. Come è mostrato schematicamente nella Fig. 16, l’ATCasi è composto da sei grandi unità catalitiche (preposte, cioè, a promuovere la reazione) la cui posizione è controllata da sei unità più piccole, che costituiscono quello che si chiama sistema regolatore. Si noti che la rappresentazione data di questo enzima nella figura non è una formula chimica e neppure un modello molecolare in scala, ma soltanto un disegno schematico che cerca di far capire il modo in cui funziona questo enzima così complesso.
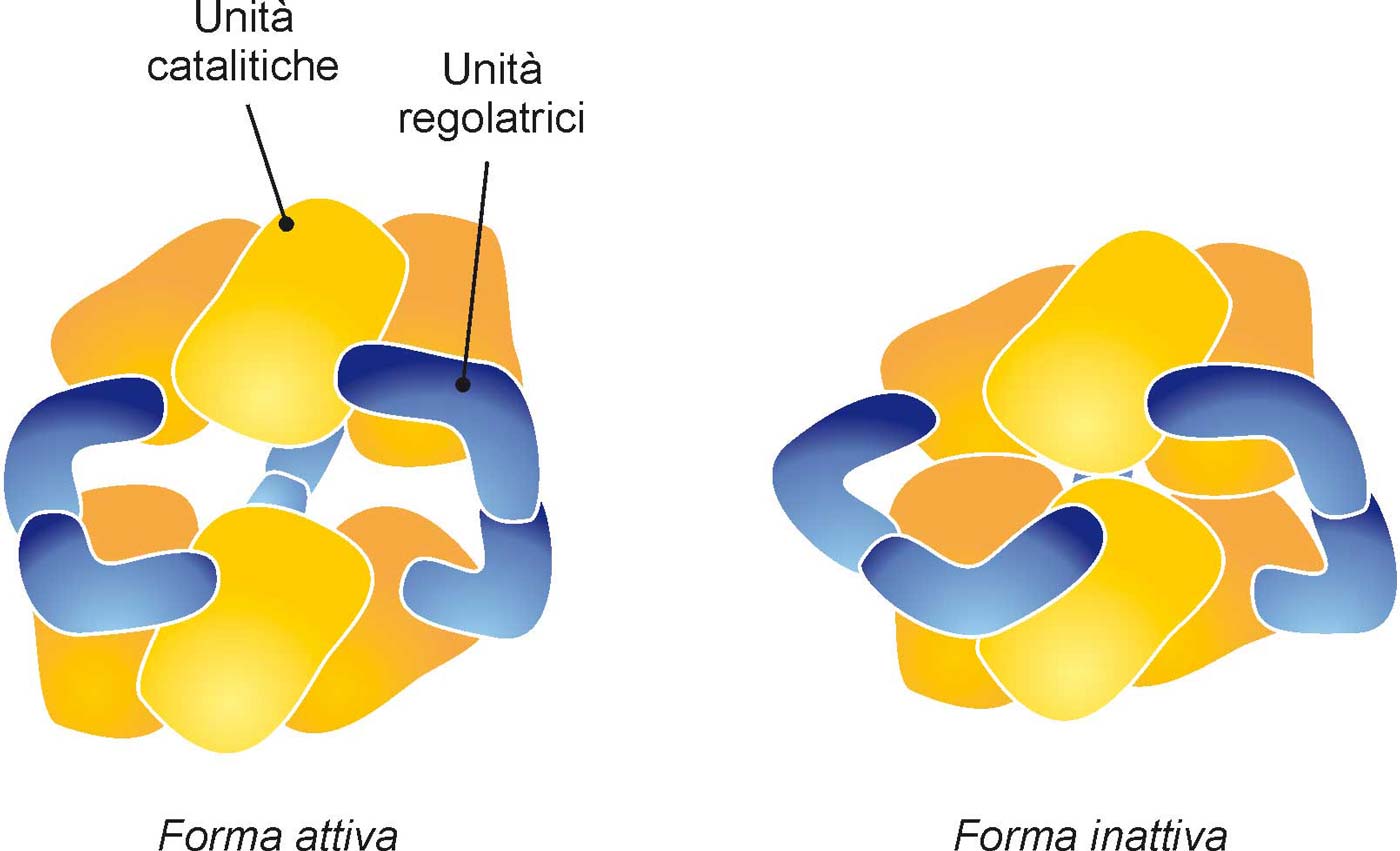
Fig. 16. L’enzima aspartato transcarbammilasi è presente nei batteri, dove è preposto alla sintesi di due molecole importanti, la timina e la citosina.
Questo enzima è in grado di autoregolarsi: un eccesso di molecole sintetizzate causa un cambiamento di forma (meccanismo allosterico) che blocca l’attività dell’enzima.
Il sito attivo dell’enzima è situato dove due unità catalitiche si affacciano; se due unità sono leggermente separate, i loro siti attivi sono liberi e funzionano mentre se sono in stretto contatto interagiscono direttamente impedendo l’accesso dei reagenti. Quando le molecole che l’enzima deve produrre si accumulano troppo, la loro presenza fa sì che le unità regolatrici cambino di forma, costringendo le unità catalitiche ad avvicinarsi fino a chiudere il sito attivo.
Enzimi come quello appena descritto, il cui funzionamento è collegato ad un cambio di forma, vengono detti allosterici (dal greco ἄλλοσ, differente, e στερεóσ, solido). Gli effetti allosterici rappresentano un modo molto efficace scelto dalla Natura per fornire al sistema segnali di retroazione (feedback) al fine di tenere sotto controllo un processo chimico.