2.2. Movimenti rotatori
Una delle nanomacchine naturali più studiate è certamente quella preposta alla sintesi dell’adenosintrifosfato (ATP), specie chimica che, come abbiamo visto (Fig. 11), fornisce l’energia per tutti i movimenti dei muscoli e che quindi presiede anche alle funzioni vitali. Questa macchina ha dimensioni dell’ordine di 10 nm ed è molto complessa (Fig. 13). Schematicamente, è costituita da un’unità cilindrica C, formata da lunghe molecole di proteine avvolte ad elica, che attraversa la membrana (parete) cellulare, e da una unità γ solidale a C. Quando la concentrazione degli ioni idrogeno (H+) all’esterno della membrana è superiore alla concentrazione che c’è all’interno, si genera un flusso di ioni idrogeno attraverso l’unità C che così inizia a ruotare come se fosse un mulino; con essa ruota anche γ che è solidale a C (Fig. 13a). L’unità γ, ruotando, agisce come una camma meccanica che deforma in successione tre siti nelle molecole di proteine α e β che la circondano, causando in ognuno di essi la trasformazione di ADP (adenosindifosfato) in ATP (Fig. 13b).
Questa macchina molecolare naturale è insomma un vero motore rotativo che, alimentato da un flusso di ioni idrogeno, produce un lavoro meccanico che a sua volta permette di convertire una sostanza a basso contenuto energetico (ADP) in una sostanza a contenuto energetico più elevato (ATP). Negli organismi, dunque, il combustibile cellulare (ATP) viene totalmente rigenerato dai propri scarti grazie ad una macchina molecolare. Per avere un’idea del lavoro stupefacente svolto da queste nanomacchine, basti pensare che in un giorno un individuo consuma suppergiù 70 kg di ATP e che ogni molecola di ATP viene riciclata in media 700 volte.
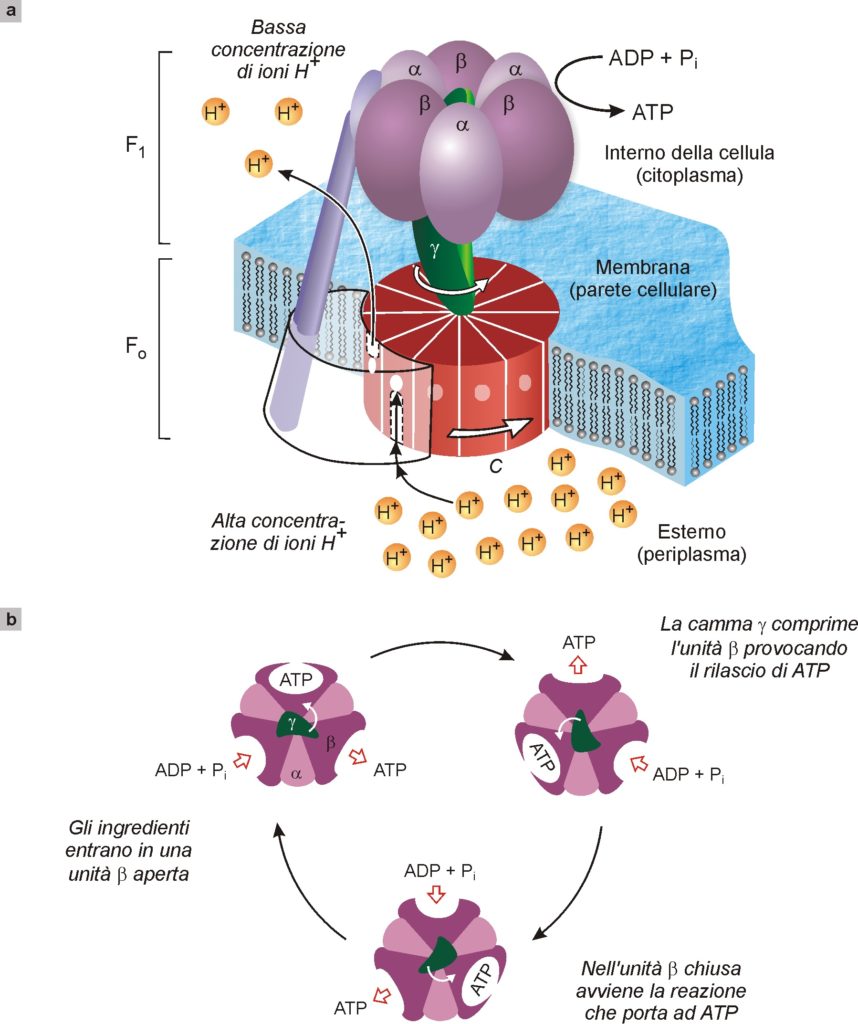
Fig. 13. Illustrazione schematica dell’enzima ATP sintasi che presiede alla sintesi dell’adenosintrifosfato (ATP) a partire da adenosindifosfato, ADP, e fosfato inorganico (Pi). Questo enzima, di dimensioni intorno a 10 nm, è costituito da due motori molecolari rotanti, FO e F1, accoppiati fra loro (a). Nel funzionamento normale dell’enzima, una diversa concentrazione di ioni idrogeno ai due lati della membrana cellulare provoca un flusso degli stessi ioni attraverso l’unità C. Tale flusso mette in moto di rotazione l’unità C come se fosse un mulino. La camma γ, solidale con C, preme in successione sulle unità catalitiche α e β di F1, provocando la formazione dell’ATP a partire dagli ingredienti ADP e fosfato. La vista da sopra dell’enzima (b) evidenzia come la camma γ, ruotando, deforma in sequenza i tre siti in cui avviene la sintesi dell’ATP.
Ma il funzionamento di questa nanomacchina è ancor più complesso e sbalorditivo. Infatti, essa combina due motori molecolari, indicati nella Fig. 13a con F1 e FO, uniti alla stessa camma γ. Questi due motori tendono entrambi a ruotare, ma in direzione opposta. Il motore FO, come sopra accennato, sfrutta il flusso di ioni idrogeno per girare in una direzione, mentre il motore F1, usando l’energia prodotta dalla conversione di ATP in ADP (cioè della reazione opposta a quella sopra menzionata) ruota in direzione opposta. Poiché i due motori sono solidali, la direzione di rotazione è imposta dal più forte. Così, quando all’interno della membrana c’è una concentrazione di ioni idrogeno più bassa che all’esterno, come accade ad esempio nei batteri a causa di un processo fotosintetico, FO è il motore più potente e F1 è costretto a girare a rovescio. In termini chimici questo significa che si “consuma” una corrente di ioni idrogeno e si produce il prezioso ATP che fornisce energia agli organismi. Quando invece all’interno della membrana gli ioni idrogeno abbondano, prevale il motore F1 che impone a FO di girare a rovescio. In termini chimici questo significa che l’organismo può usare l’energia dell’ATP per pompare gli ioni idrogeno dove è necessario immetterli.
I motori costituiti dalle proteine naturali possono essere utilizzati per far funzionare dispositivi meccanici artificiali. Un esempio di questo tipo è mostrato nella Fig. 14 (Soong 2000). Unità di F1-ATP sintasi, prelevate da un batterio, sono state fissate chimicamente su supporti metallici aventi diametro di circa 100 nm ed una altezza di circa 200 nm, fabbricati mediante litografia a fascio elettronico. Alla camma γ di ciascuna unità F1 è stata attaccata una barretta di nickel di diametro pari a 150 nm e lunga circa 1.000 nm. Quando si fornisce energia al sistema sotto forma di ATP, i nanomotori F1 si mettono a ruotare, trascinando nel loro movimento le barrette metalliche. Poiché queste ultime sono abbastanza grandi da poter essere osservate con un normale microscopio ottico, e i supporti metallici sono sufficientemente distanti fra loro, questo esperimento ha consentito di “filmare” il funzionamento di singoli motori biomolecolari.
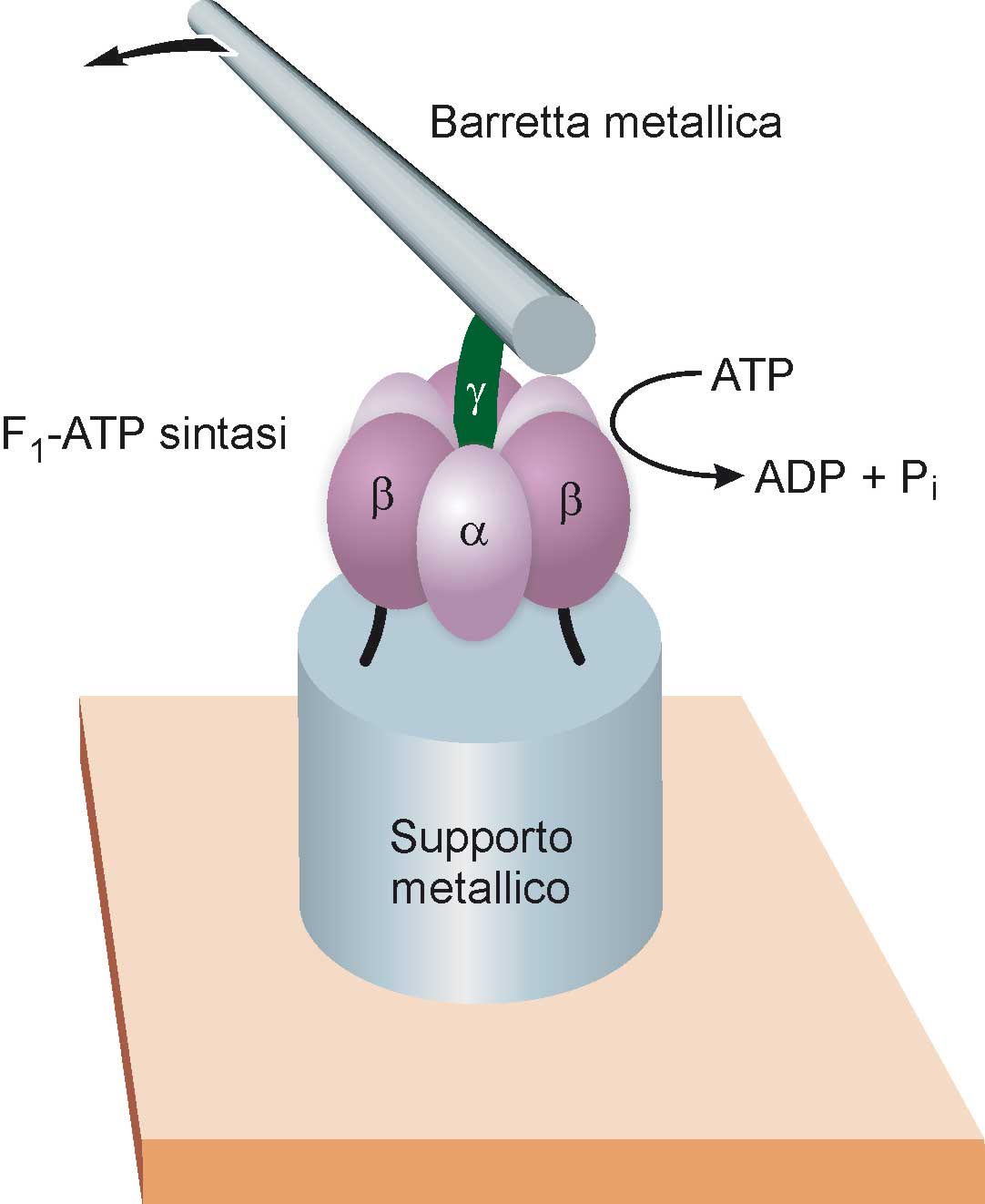
Fig. 14. La parte F1 dell’enzima ATP sintasi è stata utilizzata come motore di un nano- congegno artificiale. Le unità catalitiche α e β dell’enzima (vedi anche Fig. 13) vengono fissate su un supporto metallico del diametro di circa 100 nanometri (vedi testo), mentre alla camma γ è legata una barretta metallica della lunghezza di circa un micrometro. Somministrando ATP al sistema, il motore molecolare mette in moto la camma, che a sua volta fa ruotare la barretta metallica; quest’ultima è sufficientemente grande da poter essere osservata al microscopio ottico. Occorre sottolineare che le diverse parti dell’illustrazione non sono in scala: la barretta metallica è infatti circa cento volte più grande del motore molecolare a cui è collegata.